La correction soudaine du contrôle glycémique (c.-à-d., > 2 points de pourcentage de l’hémoglobine A1c) sur une période de 3 mois pourrait mener à une neuropathie induite par le traitement du diabète.
Les symptômes comprennent une neuropathie douloureuse, une dysautonomie, une gastroparésie ainsi qu’une détérioration précoce de la rétinopathie et de la microalbuminurie.
Les femmes et les personnes atteintes de diabète de type 1 présentent un risque plus élevé de subir une neuropathie induite par le traitement du diabète.
La prise en charge de cette maladie peut comprendre l’appui d’un nutritionniste, un ajustement de la dose d’insuline et l’utilisation de médicaments afin d’améliorer les symptômes, comme la neuropathie douloureuse, l’hypotension orthostatique et la gastro-parésie.
Une femme de 20 ans avec un antécédent de trouble de l’anxiété généralisée s’est présentée au service des urgences après plusieurs mois de polyurie et de polydipsie et une perte de poids de 10 kg (poids actuel 47,8 kg). La patiente ne présentait pas d’antécédents de toxicomanie ni de trouble de l’alimentation et ses antécédents familiaux ne montraient rien de particulier. Sa glycémie était de 40 (valeur normale 3,9–11) mmol/L et son taux d’hémoglobine A1c (HbA1c) était de 17 % (valeur normale 4,3 %–6 %). On l’a hospitalisée après un diagnostic de diabète sucré d’apparition récente (vraisemblablement de type 1) et on a amorcé un traitement à l’insuline basale et pandriale (c.-à-d., insuline dégludec, 6 unités au coucher; insuline lispro, 3 unités avant le déjeuner, le dîner et le souper), sans correction de doses. Le taux d’anticorps antiglutamate décarboxylase (AGD) de la patiente, qui mène à la destruction des cellules β pancréatiques, était élevé (5,7 [valeur normale 0–4,9] U/mL), confirmant un diabète auto-immun. Ses symptômes et sa glycémie se sont améliorés au cours des 48 heures qui ont suivi et elle a obtenu son congé.
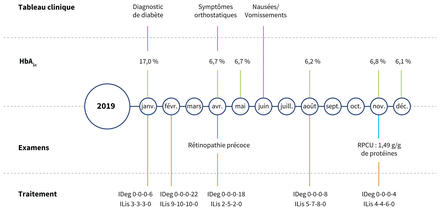
Sur une période d’un mois, l’équipe d’endocrinologie a graduellement augmenté la dose d’insuline de la patiente afin d’optimiser son contrôle glycémique à une dose d’insuline dégludec de 22 unités avant le coucher et d’insuline lispro de 9 unités avant le déjeuner et de 10 unités avant le dîner et le souper (figure 1). L’équipe de nutrition a offert des conseils alimentaires supplémentaires. Après plusieurs semaines de traitement, la patiente avait des épisodes récurrents de symptômes légers d’hypoglycémie, diagnostiqués par une surveillance de la glycémie à domicile. De ce fait, on a réduit le dosage de son insuline à plusieurs reprises. Trois mois après le début du traitement, les symptômes s’étaient résorbés pour la plupart, la patiente prenait 18 unités d’insuline dégludec avant le coucher et 2 unités d’insuline lispro avant le déjeuner et le souper et 5 unités avant le dîner.
Chronologie des événements comprenant le tableau clinique, l’hémoglobine glyquée A1c (HbA1c), les examens et les schémas thérapeutiques. Le dosage de l’insuline est représenté comme suit: 0-0-0-6 fait référence à 6 unités au coucher et 3-3-3-0 fait référence à 3 unités avant le déjeuner, le dîner et le souper. Remarque: IDeg = insuline dégludec, ILis = insuline lispro, RPCU = ratio de protéine à créatine dans l’urine.
Plusieurs complications associées au diabète et au traitement se sont manifestées chez notre patiente. Après 3 mois de traitement, son taux d’hémoglobine glyquée HbA1c était de 6,7 %. À peu près au même moment, elle a signalé des épisodes d’étourdissements graves et nous avons diagnostiqué une hypotension orthostatique (une pression artérielle en décubitus dorsal de 115/83 mm Hg comparativement à une pression artérielle en position debout de 76/59 mm Hg). Les principaux diagnostics différentiels étaient une insuffisance surrénale et une neuropathie induite par le traitement du diabète. L’équipe d’endocrinologie a demandé des analyses matinales de cortisol, de B12, de thyréostimuline et d’anticorps antineuronaux et a traité les symptômes de la patiente avec de la midodrine (5 mg 3 fois par jour) et de la fludrocortisone (0,05 mg 2 fois par jour). Ils l’ont aussi orientée vers le service de neurologie pour l’évaluation d’une possible neuropathie induite par le traitement du diabète.
Tous les résultats des analyses de laboratoire étaient normaux à cette étape. Les tests de réflexes automatiques ont démontré des oscillations cardiaques réduites au repos et une réponse cardiomotrice atténuée à la respiration profonde et à la manœuvre de Valsalva, cohérentes avec une dysautonomie. Un test de surélévation de la tête a montré une hypotension orthostatique substantielle. L’équipe de neurologie a confirmé un diagnostic de neuropathie induite par le traitement du diabète. Peu de temps après, une douleur lancinante s’est manifestée dans les extrémités inférieures de la patiente. Des études de conduction nerveuse ont confirmé une neuropathie sensorielle des grandes et des petites fibres. L’équipe d’endocrinologie a prescrit de la venlafaxine, dans le but de soulager à la fois la douleur et l’anxiété. L’équipe de neurologie a aussi suggéré un dépistage rétinien qui a permis de diagnostiquer une rétinopathie proliférative légère et précoce qui n’a pas nécessité d’intervention immédiate.
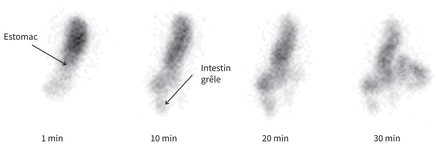
Six mois après le diagnostic, notre patiente a développé des nausées et des vomissements rebelles. Une ultrasonographie abdominale, une gastroscopie et une tomodensitométrie abdominale n’ont rien décelé de particulier. Malgré un traitement au métoclopramide, ses symptômes ont persisté, nécessitant des hospitalisations à répétition. Une étude de vidange gastrique a confirmé une vidange retardée des liquides et on a posé un diagnostic de gastroparésie (figure 2). En travaillant de concert avec un nutritionniste clinique, la patiente a tenté une alimentation adaptée à la gastroparésie, mais a éprouvé des difficultés à s’y conformer. Différents médicaments, dont l’ondansétron, la dompéridone, l’érythromycine, le nabilone, la kétamine, le prucalopride et l’halopéridol, n’ont pas réussi à soulager ses symptômes. Des injections de toxine botulinique dans le pylore ont montré peu d’effets. Dix mois après le début du traitement, une microalbuminurie s’est manifestée (1,49 [valeur normale < 0,15] g/g), bien que son taux de filtration glomérulaire n’était pas affecté.
Étude de vidange gastrique des liquides montrant un taux de vidange substantiellement réduit. Normalement, 50 % du contenu de l’estomac se sera vidangé après 6–20 minutes. La demi-vie est extrapolée à 57 minutes.
Au cours de l’année et demie qui a suivi, l’hypotension orthostatique de la patiente s’est améliorée et son endocrinologue a interrompu la prescription de midodrine. Elle a mentionné une prise en charge adéquate de la douleur à l’aide de la venlafaxine, mais ses symptômes de nausées et de vomissements ont persisté. Elle a continué à prendre de la dompéridone et de l’ondansétron, accompagnés d’halopéridol au besoin. Sa rétinopathie s’est améliorée, sa microalbuminurie est revenue à un niveau normal et son hémoglobine HbA1c se trouvait entre 6,1 % et 7,1 %.
Discussion
La neuropathie induite par le traitement du diabète se définit comme l’apparition d’une neuropathie après un contrôle glycémique agressif. Connue auparavant comme une névrite insulinique, elle a été associée à toute intervention pharmacologique ou de l’hygiène de vie (dont une perte de poids rapide et une restriction calorique importante) qui mène à une correction trop soudaine de l’hémoglobine glyquée (HbA1c)1. Selon une étude rétrospective de la documentation de 2015 composée de 954 patients qui étaient suivis à Boston pour une neuropathie diabétique, jusqu’à 10 % des patients atteints de diabètes ont subi une augmentation brusque de leurs douleurs neuropathiques ou de leurs symptômes automatiques après une modification soudaine de leur contrôle glycémique, ce qui laisse croire que ce diagnostic est sous-déclaré2. L’étude définissait un changement soudain comme étant supérieur à 2 points de pourcentage de HbA1c sur une période de 3 mois. Parmi les patients atteints de diabète dont l’hémoglobine glyquée avait été abaissée d’un taux inférieur à 2 points de pourcentage sur une période de 3 mois, le risque de présenter des symptômes neuropathiques était de 4,3 %. Un grand nombre d’études, dont l’une décrivant le syndrôme en question chez des femmes présentant des troubles alimentaires, corroborait l’existence d’un risque accru de neuropathie induite par le traitement du diabète après une correction soudaine de l’HbA1c 1,3–6.
On croit que les mécanismes menant à ce type de neuropathie sont associés à l’apoptose induite par une privation soudaine de glucose, la formation de dérivations artérioveineuses entraînant une ischémie de l’endonèvre et une régénération des fibres nerveuses causant la douleur4,7. Elle se produit plus fréquemment chez les patients atteints de diabète de type 1 plutôt que de type 2: une étude a rapporté que 76 des 104 patients présentant une neuropathie induite par le traitement du diabète étaient de type 12. Les patients susceptibles de présenter ce type de neuropathie avaient souvent des antécédents de longue date d’hyperglycémie qui, en moyenne, perduraient depuis 5–10 ans2.
La principale manifestation clinique de cette neuropathie est la douleur neuropathique1. L’hypotension orthostatique est observée dans 69 % des cas, plus fréquemment en présence de diabète de type 1 que de type 25. Les symptômes gastro-intestinaux sont fréquents3; une petite étude composée de 16 patients qui présentaient une douloureuse neuropathie aiguë a relevé la présence de nausées chez 69 % des patients et des vomissements chez 56 % de ceux-ci5. Cependant, il est quelque peu atypique que les symptômes gastro-intestinaux supplantent la douleur causée par la neuropathie périphérique, comme dans le cas de notre patiente.
Les données sur les effets d’un contrôle glycémique agressif sur les complications microvasculaires sont limitées. Dans l’étude DCCT (Diabetes Control and Complications Trial) sur le contrôle du diabète et de ses complications, qui était composée de 1441 patients atteints de diabète de type 1, une rétinopathie précoce s’est manifestée chez 22 % des patients suivant une insulinothérapie intensive, comparativement à 13 % des patients du groupe suivant la thérapie conventionnelle4,8. Cela pouvait survenir très tôt, à peine 3 mois après le début du traitement8. Malgré cette observation, le contrôle glycémique intensif a mené à l’amélioration de l’ensemble des résultats au cours des 18 années de l’enquête8. Dans une étude rétrospective de 104 patients atteints de neuropathie induite par le traitement du diabète, 17 % des patients présentaient une microalbuminurie dès le départ comparativement à 84 % d’entre eux, 1 an après le diagnostic de la neuropathie2. Des élévations du niveau de créatine sont peu fréquentes1.
Prise en charge et pronostic
Des données sont manquantes pour guider une prise en charge optimale de la neuropathie induite par le traitement du diabète. L’avis actuel des experts, fondé uniquement sur des données observationnelles, est d’éviter la neuropathie en limitant le taux de diminution de l’hémoglobine glyquée (HbA1c) à moins de 2 points de pourcentage (p. ex., de 8 à 6) sur une période de 3 mois2. En pratique, cependant, cela peut être difficile à atteindre et est sujet à débat. Certaines études de cas et de cohorte ont montré que la neuropathie douloureuse pourrait s’améliorer de façon substantielle après avoir allégé le contrôle glycémique; 1 étude a aussi souligné une amélioration de la rétinopathie diabétique précoce1,9. De ce fait, certains experts suggèrent une période de tolérance d’hyperglycémie comme « traitement de rattrapage », alors que d’autres ont mis en doute cette approche6,10. Une petite étude de cohorte longitudinale a suivi 26 patients présentant une neuropathie induite par le traitement du diabète pendant 8 ans1. L’ensemble des 19 patients qui ont maintenu un contrôle glycémique stable et adéquat (HbA1c entre 6 % et 8,5 %) après l’apparition des symptômes de cette neuropathie ont montré une amélioration graduelle des symptômes de leur maladie sur une période de plusieurs années, avec un rétablissement fonctionnel quasi complet qui laisse croire que le syndrome est réversible jusqu’à un certain degré. À l’inverse, la neuropathie, la rétinopathie et la néphropathie des 7 patients dont le contrôle glycémique était inadéquat et instable s’étaient détériorées.
Malgré un accroissement de la sensibilisation à la neuropathie induite par le traitement du diabète, les données sont insuffisantes pour proposer une approche de traitement uniforme pour le moment. La norme thérapeutique actuelle demeure favorable et évite une correction excessivement rapide au début du traitement, particulièrement chez les patients présentant des facteurs de risque comme le diabète de type 1 ou un antécédent d’hyperglycémie de longue date; les femmes et les personnes atteintes de troubles alimentaires sont aussi à risque.
Les soins de soutien ressemblent actuellement à la prise en charge traditionnelle de complications semblables chez des patients présentant un contrôle glycémique inadéquat de longue date. Une analyse appropriée de la neuropathie douloureuse et de la dysautonomie peut comprendre une consultation auprès d’un neurologue afin d’obtenir un examen spécialisé. Le traitement comprend typiquement l’emploi d’un seul agent neuropathique (c.-à-d., un antiépileptique ou un antidépresseur), mais peut parfois nécessiter une combinaison de thérapies4. Les antidépresseurs tricycliques, s’ils sont administrés, doivent être utilisés avec précaution, car ils pourraient exacerber l’hypotension orthostatique.
Quant aux symptômes associés à la gastroparésie, tous les patients chez qui on suspecte une vidange gastrique retardée devraient être orientés vers un gastroentérologue pour obtenir un examen endoscopique et possiblement un examen abdominal par imagerie pour exclure une sténose du défilé gastrique11. Un diagnostic formel nécessite une étude de vidange gastrique par scintigraphie, idéalement avec des aliments solides, s’ils sont tolérés11. La participation d’un nutritionniste est recommandée. Le traitement de première ligne comprend habituellement des changements alimentaires (une alimentation hypolipidique, à faible teneur en fibres et composée d’aliments mous ou coupés en petits morceaux) et des agents de promotilité, comme la métoclopramide ou la dompéridone, qui doivent être suivis en raison de leurs effets indésirables potentiels11. Les antiémétiques comme l’ondansétron ou la diphénhydramine sont souvent ajoutés aux schémas thérapeutiques chez les patients présentant des symptômes réfractaires11. L’érythromycine, un agoniste de la motiline peut aussi être utilisé, bien que son efficacité à long terme soit limitée par la tachyphylaxie11. Les antagonistes des récepteurs de la sérotonine, comme le prucalopride, s’ils sont tolérés, peuvent améliorer la vidange gastrique11. Le nabilone et l’halopéridol ont été employés avec notre patiente en raison de leur capacité à contrôler les nausées et les vomissements causés par la chimiothérapie, bien qu’ils ne sont pas typiquement indiqués dans le cas de la gastroparésie. Les symptômes réfractaires peuvent justifier l’examen de thérapies plus invasives comme la stimulation électrique gastrique11.
La section Études de cas présente de brefs rapports de cas à partir desquels des leçons claires et pratiques peuvent être tirées. Les rapports portant sur des cas typiques de problèmes importants, mais rares ou sur des cas atypiques importants de problèmes courants sont privilégiés. Chaque article commence par la présentation du cas (500 mots maximum), laquelle est suivie d’une discussion sur l’affection sous-jacente (1000 mots maximum). La soumission d’éléments visuels (p. ex., tableaux des diagnostics différentiels, des caractéristiques cliniques ou de la méthode diagnostique) est encouragée. Le consentement des patients doit impérativement être obtenu pour la publication de leur cas. Renseignements destinés aux auteurs: www.cmaj.ca.
Footnotes
Voir la version anglaise de l’article ici: www.cmaj.ca/lookup/doi/10.1503/cmaj.202091
Intérêts concurrents: Aucun déclaré.
Cet article a été révisé par des pairs.
Les auteurs ont obtenu le consentement de la patiente.
Collaborateurs: Les deux auteures ont contribué de façon substantielle à l’acquisition et à l’analyse des données, ont rédigé et révisé le manuscrit, ont donné leur approbation finale pour la version destinée à être publiée et endossent l’entière responsabilité de tous les aspects du travail.
Il s’agit d’un article en libre accès distribué conformément aux modalités de la licence Creative Commons Attribution (CC BY-NC-ND 4.0), qui permet l’utilisation, la diffusion et la reproduction de tout médium à la condition que la publication originale soit adéquatement citée, que l’utilisation se fasse à des fins non commerciales (c.-à-d., recherche ou éducation) et qu’aucune modification ni adaptation n’y soit apportée. Voir: https://creativecommons.org/licenses/by-nc-nd/4.0/deed.fr